Efecto de una selección de bioestimulantes microbianos comerciales en la salud del suelo y la calidad del fruto en almendro

Autores:
María José García-Luna1, Ana Belén Huertas-García1, Jesús Palma-López1, María-Dolores Rey2, Antonio R. Sánchez-Rodríguez1
1. Unidad de Edafología, Departamento de Agronomía, ETSIAM, Universidad de Córdoba, Campus de Rabanales, Edificio C4, 14071 Córdoba, España.
2. Bioquímica, Proteómica y Biología de Sistemas Vegetal y Agroforestal. Departamento de Bioquímica y Biología Molecular, Universidad de Córdoba, Campus de Rabanales, Edificio C6, 14071 Córdoba, España.
1. Introducción
La preocupación creciente por el impacto ambiental de la agricultura intensiva, unido a la necesidad de mantener la productividad para satisfacer la demanda de alimento y productos agrícolas a nivel mundial ha impulsado la búsqueda de estrategias más sostenibles. Según el Reglamento (UE) 2019/1009, los bioestimulantes son productos que estimulan los procesos de nutrición vegetal independientemente de su contenido en nutrientes, con el fin de mejorar la eficiencia en el uso de insumos, la tolerancia al estrés abiótico o la disponibilidad de nutrientes en la rizosfera. En este escenario, el uso de bioestimulantes es una opción prometedora para reducir la utilización de fertilizantes y fitosanitarios, especialmente en cultivos mediterráneos como el almendro (Prunus dulcis Mill. D. A. Webb), cuya presencia es notable en zonas del sur de España como Andalucía. Desde los trabajos pioneros de Filatov en los años 40 hasta definiciones más funcionales de los bioestimulantes (Kauffman et al., 2007; du Jardin, 2015), el concepto ha evolucionado, al igual que su mercado, valorado en 4.300 millones de dólares en 2024 y con previsiones de alcanzar los 7.600 millones en 2029. Europa lidera el mercado de los bioestimulantes, y España figura entre los principales países productores y consumidores, con un 85 % del mercado nacional dominado por bioestimulantes no microbianos (AEFA, 2024).
Los bioestimulantes pueden clasificarse en no microbianos y microbianos. Los bioestimulantes no microbianos incluyen extractos de algas, aminoácidos, ácidos húmicos, así como compuestos inorgánicos como silicio o fosfitos, todos ellos con efectos positivos sobre el crecimiento vegetal y la microbiota del suelo (Apone et al., 2010; Canellas et al., 2015). Entre los segundos destacan las bacterias promotoras del crecimiento vegetal (PGPR), como Rhizobium, Azospirillum o Bacillus, y los hongos micorrícicos, como Funneliformis mosseae o Rhizophagus irregularis. Estos microorganismos facilitan la absorción de nutrientes, estimulan el desarrollo radicular y mejoran la tolerancia a condiciones adversas. A pesar de su potencial, el conocimiento sobre los mecanismos de acción de muchos bioestimulantes sigue siendo limitado, y los resultados varían en función del tipo de suelo, clima, manejo, momento de aplicación y cultivo (Di Marco & Osti, 2009; Cerdán et al., 2013). Aunque se consideran productos seguros, biodegradables y ecológicamente sostenibles, su regulación es aún incipiente en algunos países (Thomas et al., 2013; Traon et al., 2014).
En el caso del almendro, el segundo frutal más cultivado en España con más de 765.000 ha (FAOSTAT, 2025), los estudios sobre bioestimulantes son aún escasos. La mayoría se han centrado en productos no microbianos y han reportado beneficios sobre el crecimiento y la resistencia al estrés hídrico (Mondragón-Valero et al., 2020; Pascoalino et al., 2021). Sin embargo, falta información sobre su efecto en la salud del suelo y la calidad del fruto. Ante este contexto, el presente estudio tuvo como objetivo principal evaluar el efecto de distintos bioestimulantes comerciales microbianos (incluyendo fijadores de N, solubilizadores de P y K, y micorrizas), centrándose en su influencia en la comunidad y estructura microbiana (bacterias y arqueas), así como en la producción y calidad del fruto (calibre y metabolitos primarios y secundarios). Esta investigación se enmarca en la búsqueda de estrategias agronómicas que contribuyan a una mayor sostenibilidad y resiliencia del cultivo del almendro en entornos mediterráneos semiáridos.
2. Materiales y métodos
2.1. Diseño experimental
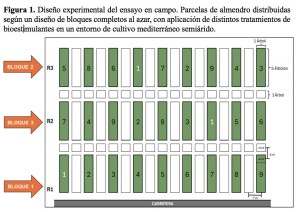
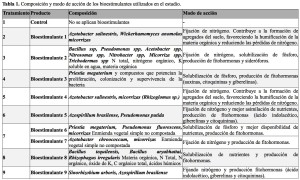
La finca Cortijo de la Reina, situada en el término municipal de Córdoba (98,5 m s.n.m.; 37°49’15.2″N, 4°53’52.4″O), alberga una plantación de almendro establecida en octubre de 2020 con la variedad Avijor (Lauranne), injertada sobre patrón híbrido G×N (almendro × melocotonero), seleccionado por su resistencia a nematodos agalladores y tolerancia a suelos calcáreos. El marco de plantación es de 7 × 4 m, y el sistema de riego por goteo está compuesto por dos líneas con emisores espaciados a 0,75 m y un caudal de 1,6 L/h. En dicha finca comercial, se estableció un ensayo de campo en 2023 según un diseño de bloques completos al azar (R1, R2, R3) y nueve tratamientos (Figura 1), de los cuales uno correspondía al tratamiento control (1) sin aplicación de bioestimulantes, y los ocho restantes correspondían a diferentes bioestimulantes comerciales (del 2 al 9). La Tabla 1 muestra los distintos tratamientos en detalle. Cada bloque incluyó nueve parcelas elementales, compuestas por cinco árboles de almendro que constituyeron la unidad experimental en este ensayo. Para minimizar efectos de borde, se dejó una fila de separación entre tratamientos dentro de cada bloque y entre bloques, separando los tratamientos. Los bioestimulantes se aplicaron en abril de 2023 y 2024, conforme a las dosis recomendadas por los fabricantes (Tabla 1). La aplicación se realizó a 10–15 cm de profundidad, en la línea de los goteros (zona del bulbo húmedo), para favorecer su contacto con la raíz del almendro.
2.2. Caracterización del suelo y análisis de la estructura de la comunidad microbiana
Se determinaron diversas propiedades físico-químicas del suelo, que se muestran en la Tabla 2, como la textura, el contenido en materia orgánica (MO), en carbonatos (CaCO3), el pH en la relación 1:2.5 (suelo:agua; pH1:2,5), la conductividad eléctrica en la relación 1:5 (suelo:agua; CE1:5), la capacidad de intercambio catiónico (CIC) mediante extracción con acetato amónico a pH 7.0, el fósforo disponible mediante el método Olsen (POlsen) extraído con bicarbonato sódico (NaHCO₃) 0.5 M y a pH 8.5, el potasio asimilable extraído con acetato (Kasimilable), y la disponibilidad de micronutrientes tras extracción con ácido dietilentriaminopentaacético (DTPA) (CuDTPA, MnDTPA, ZnDTPA, y FeDTPA).
La biomasa microbiana del suelo (Cm, Nm y Pm) se determinó mediante el método de fumigación con cloroformo (Vance et al., 1987), calculando la diferencia de C, N y P orgánicos disueltos en extractos obtenidos con K₂SO₄ 0,5 M tras 30 minutos de agitación. Las concentraciones de Cm y Nm se analizaron con un analizador TOC/TON, y el Pm se midió por espectrofotometría a 882 nm (PowerWave HT-BioTek). Las determinaciones se realizaron antes y después de la exposición a una atmósfera de cloroformo durante 7 días.
La diversidad microbiana del suelo, enfocándose en arqueas y bacterias, se analizó mediante extracción de ADN a partir de 0,25–0,50 g de muestra, utilizando el kit PowerSoil® (Qiagen). La secuenciación metagenómica fue realizada por Novogene empleando la plataforma Illumina NovaSeq X Plus con lectura pareada de 150 pb (PE150), siguiendo el protocolo descrito por Handelsman et al. (2002). Posteriormente, se llevó a cabo el análisis taxonómico.
2.3. Determinación de la producción y calidad del fruto
De los cinco árboles de cada unidad experimental, se cosechó la producción de los tres árboles centrales, registrando el peso total (kg) en septiembre de 2023 y 2024. A continuación, se tomó una muestra representativa de cada unidad experimental. Se pesaron 100 almendras con cáscara y, tras partirlas, se volvió a pesar la muestra sin cáscara, lo que permitió calcular el rendimiento grano/cáscara. Además, las almendras se clasificaron según su calibre en tres categorías: mayor de 14 mm, entre 12 y 14 mm, y menor de 12 mm, determinando el porcentaje que representaba cada categoría respecto al total.
La calidad del fruto se evaluó a partir de un extracto de metabolitos obtenido del propio fruto, utilizado para el análisis de metabolitos primarios (almidón, azúcares y aminoácidos) y secundarios (compuestos fenólicos, flavonoides y taninos). La preparación del extracto siguió la metodología descrita por López-Hidalgo et al. (2021). Finalmente, los azúcares solubles totales y el almidón se midieron mediante el método de la antrona (Chow et al., 2004).
2.4. Análisis estadístico
Los datos se analizaron con STATISTIX v.10 mediante un análisis de varianza (ANOVA) y el test post hoc LSD (Least Significant Difference), aplicando transformaciones o pruebas no paramétricas (Kruskal-Wallis y Dunn) cuando no se cumplían normalidad de datos u homocedasticidad.
3. Resultados y discusión
El análisis previo del suelo antes de la aplicación de los bioestimulantes reveló una textura arcillosa, un contenido de materia orgánica superior al 2 % (considerable, dadas las condiciones edafoclimáticas) y un elevado nivel de CaCO3, en torno al 22 % (Figura 1). El pH era básico, con un valor de 8,3, y no se detectaron problemas de salinidad, ya que la conductividad eléctrica se situaba por debajo de 0,24 dS·m⁻¹. El contenido de Kasimilable fue alto, superando los 150 mg·kg⁻¹, mientras que el POlsen era relativamente bajo para cultivo de almendro en secano. Respecto a los micronutrientes extraídos con DTPA, los niveles de CuDTPA, MnDTPA, y Fe DTPA se situaron por encima de los umbrales críticos establecidos (0,2 mg kg-1, 1 mg kg-1, 4,5 mg·kg⁻¹ de suelo, respectivamente). En cambio, los valores de ZnDTPA fueron considerablemente bajos, situándose muy por debajo de su umbral crítico (0,8 mg·kg⁻¹ de suelo), lo que podría inducir deficiencias en el cultivo.
En general, la aplicación de bioestimulantes no produjo efectos significativos a corto plazo sobre las propiedades físico-químicas del suelo (datos no mostrados). Este resultado es esperable, ya que modificaciones en propiedades como el contenido de carbono orgánico o la disponibilidad de ciertos nutrientes del suelo suelen manifestarse a medio o largo plazo tras aplicaciones continuadas de estos productos. No obstante, la respuesta a la aplicación de bioestimulantes fue más evidente en los indicadores de biomasa microbiana (Cm, Nm y Pm). Se observaron incrementos significativos (p < 0,05) en los contenidos de los indicadores en la mayoría de los tratamientos de bioestimulantes. El Cm alcanzó su valor máximo en el tratamiento 5, lo que sugiere una mayor actividad y presencia microbiana. En el caso del Nm, el tratamiento 9 presentó los valores más altos, seguido de los tratamientos 2, 3, 5, 7 y 8. Valores elevados de Cm y Nm indican una mayor retención de C y N en el suelo debido a absorción por parte de los microorganismos del suelo (y utilización para multiplicación), lo cual puede reducir las pérdidas por lixiviación y mejorar la actividad microbiana, favoreciendo la funcionalidad del suelo y su productividad a medio plazo. El Pm se vio incrementado significativamente en los tratamientos 2, 3, 6 y 9, lo que sugiere una mayor inmovilización, actuando como una reserva potencialmente disponible para el cultivo a corto plazo (Oberson y Joner, 2005).
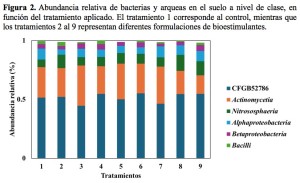
En la Figura 2 se muestra la estructura de la comunidad microbiana de bacterias y arqueas del suelo a nivel de clase (para 2023). La aplicación de bioestimulantes modificó la estructura de la comunidad microbiana, observándose un aumento en la abundancia relativa de Actinomycetia en los tratamientos 3, 5 y 7, respecto al control (1). Este grupo taxonómico incluye microorganismos que desempeñan un papel clave en la descomposición de la materia orgánica, y algunas de sus especies poseen la capacidad de fijar N atmosférico, así como de producir antibióticos y otros metabolitos bioactivos (Bhatti et al., 2017). Asimismo, se observó un incremento en la abundancia relativa de la clase Nitrososphaeria tras la aplicación de la mayoría de bioestimulantes (excepto el 3). Esta clase, perteneciente al dominio Archaea, e incluye microorganismos que participan activamente en los procesos de nitrificación del suelo (Bei et al., 2024). En los tratamientos 3, 4 y 9 también se registró un aumento en la abundancia relativa de Betaproteobacteria respecto al control. Este grupo incluye microorganismos con funciones clave en la fertilidad del suelo, como la fijación de N, la mineralización de materia orgánica y la desnitrificación (Gazdag et al., 2019). Por otro lado, en el suelo del tratamiento 2 se incrementó la abundancia relativa de la clase Bacilli, conocida por su capacidad para producir fitohormonas, solubilizar P y K, y ejercer efectos antagonistas frente a patógenos (Mukhopadhyay et al., 2023).
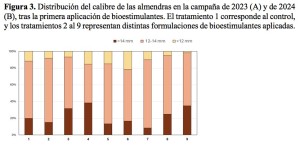
A nivel de producción, los tratamientos con bioestimulantes no generaron diferencias significativas en la producción total, ni el peso del fruto. Sin embargo, en la campaña de 2023 se observaron diferencias estadísticamente significativas en el calibre de las almendras (Figura 3). En particular, los tratamientos 4 y 9 presentaron un mayor porcentaje de frutos con un tamaño superior a 14 mm (38 % y 35 %, respectivamente), con diferencias significativas (p < 0,05) en comparación con el control y el resto de los tratamientos, cuyos valores oscilaron entre el 8 % y el 17 %. Por otro lado, en el calibre medio (12–14 mm), el mayor porcentaje se registró en el tratamiento 7 (82 %), que presentó diferencias significativas (p = 0,080) respecto a los tratamientos 3, 4 y 6 (46–62 %). En el calibre menor (< 12 mm), aunque no se observaron diferencias estadísticamente significativas, el mayor porcentaje correspondió al control. Durante la campaña de 2024, aunque no se detectaron diferencias significativas entre los tratamientos, se observó un aumento general en el calibre de las almendras. Este incremento se atribuye, probablemente, a la mayor precipitación acumulada durante el año agronómico, lo que pudo favorecer el desarrollo del fruto independientemente del tratamiento aplicado (Figura 3B). Este aumento en el calibre ha sido reportado en otros estudios, aunque en dichos trabajos se emplearon bioestimulantes no microbianos a base de extractos de algas (Eroğul et al., 2022; Oliveira et al., 2022). La comparación con estudios previos destaca el potencial de los bioestimulantes microbianos como alternativa a los productos no microbianos en estrategias orientadas a la mejora de la calidad del fruto.
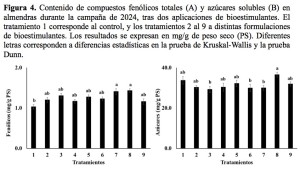
La calidad del fruto, evaluada a partir del análisis de metabolitos primarios y secundarios, mostró diferencias estadísticamente significativas en el contenido de compuestos fenólicos totales (Figura 4A) y azúcares solubles (Figura 4B). En particular, los tratamientos 7 y 8 presentaron un mayor contenido de compuestos fenólicos (1,41 y 1,43 mg g⁻¹, respectivamente) en comparación con el tratamiento control (1,03 mg g⁻¹). Asimismo, el tratamiento 8 destacó por un contenido superior en azúcares solubles (36,56 mg g⁻¹) frente a los tratamientos 3, 6 y 7, que registraron valores entre 29,24 y 30,00 mg g⁻¹. Los azúcares solubles cumplen funciones clave en el metabolismo del fruto: actúan como osmoprotectores, ayudando a preservar la integridad celular bajo condiciones de estrés abiótico como la sequía, y sirven como fuente de carbono para rutas biosintéticas responsables de la producción de metabolitos secundarios, como compuestos fenólicos y flavonoides. Además, un mayor contenido en azúcares mejora las características organolépticas del fruto, especialmente su sabor, lo que incrementa su valor comercial y la aceptación por parte del consumidor. Por otro lado, el contenido de flavonoides mostró una tendencia general al alza en todos los tratamientos, con una media de 0,93 mg g⁻¹, aunque sin alcanzar diferencias significativas. El aumento en flavonoides no solo mejora el valor nutricional del fruto, sino que también refuerza su resistencia frente a plagas, enfermedades y factores de estrés abiótico. Estos compuestos, junto con los compuestos fenólicos, contribuyen activamente a los mecanismos de defensa del cultivo debido a sus propiedades antimicrobianas y antifúngicas, y mejoran la estabilidad del fruto tras su procesamiento. Además, ofrecen protección frente a condiciones ambientales adversas, como la sequía, lo que resulta especialmente relevante en regiones áridas (Moreno Gracia et al., 2021).
4. Conclusiones
En la finca La Reina (2023-2024), la aplicación de bioestimulantes no produjo cambios significativos inmediatos en las propiedades físico-químicas del suelo, manteniéndose estables parámetros como pH, materia orgánica y salinidad. Sin embargo, sí se observaron modificaciones relevantes en la comunidad microbiana edáfica, con incrementos en grupos clave como Actinomycetia, Nitrososphaeria y Bacilli, lo que sugiere una posible mejora en la fertilidad y funcionalidad del suelo a medio y largo plazo. En cuanto al fruto, se evidenció una mejora significativa en el calibre, con mayor proporción de almendras mayores de 14 mm en los tratamientos 4 y 9, y un aumento de frutos de calibre medio en el tratamiento 7, beneficiando la calidad comercial. Además, la calidad bioquímica del fruto mejoró con incrementos en compuestos fenólicos totales y flavonoides, que potencian su valor nutricional y su resistencia frente a estrés biótico y abiótico. También se registró un aumento en el contenido de azúcares solubles, especialmente en el tratamiento 8, lo que no solo mejora el sabor y la aceptación comercial del fruto, sino que además actúa como fuente de energía para rutas biosintéticas clave y contribuye a la tolerancia frente a condiciones de estrés ambiental. Estos resultados respaldan el uso de bioestimulantes microbianos como una estrategia sostenible para mejorar la calidad del cultivo y promover sistemas agrícolas más resilientes.
Financiación
El estudio ha sido desarrollado por proyecto subvencionado por las Ayudas a Grupos Operativos de la Asociación Europea de Innovación (ARI) en materia de productividad y sostenibilidad agrícolas. Convocatoria 2022 Orden de 7 de julio de 2020. Nº GOPG-CO-23-0010.
Bibliografía
AEFA, 2024. https://www.biostimulant.com/es/blog-29-biostimulants-research-global-trends-in-2021/
Ahmad, I., Pichtel, J., Hayat, S., 2008. Plant-Bacteria Interactions. Strategies and Techniques to Promote Plant Growth. WILEY-VCH Verlag GmbH and Co., KGaA, Weinheim.
Apone, F., Tito, A., Carola, A., Arciello, S., Tortora, A., Filippini, L., Monoli, I., Cucchiara, M., Gibertoni, S., Chrispeels, M. J., & Colucci, G. (2010). A mixture of peptides and sugars derived from plant cell walls increases plant defense responses to stress and attenuates ageing-associated molecular changes in cultured skin cells. Journal of Biotechnology, 145, 367–376.
Babalola, O.O., 2010. Beneficial bacteria of agricultural importance. Biotechnol. Lett. 32, 1559–1570.
Bei, Q., Reitz, T., Schädler, M., Hodgskiss, L. H., Peng, J., Schnabel, B., … & Heintz-Buschart, A. (2024). Metabolic potential of Nitrososphaera-associated clades. The ISME Journal, 18(1), wrae086.
Bhatti, A. A., Haq, S., & Bhat, R. A. (2017). Actinomycetes benefaction role in soil and plant health. Microbial pathogenesis, 111, 458-467.
Canellas, L. P., Olivares, F. L., Aguiar, N. O., Jones, D. L., Nebbioso, A., Mazzei, P., & Piccolo, A. (2015). Humic and fulvic acids as biostimulants in horticulture. Scientia Horticulturae, 196, 15–27.
Cerdan, M., Sanchez-Sanchez, A., Jorda, J. D., Juarez, M., and Sanchez-Andreu, J. (2013). Effect of commercial amino acids on iron nutrition of tomato plants grown under lime-induced iron deficiency. J. Plant Nutr. Soil Sci. 176, 859–866.
Chow PS, Landhäusser SM. A method for routine measurements of total sugar and starch content in woody plant tissues. Tree Physiol. 2004; 24:1129-36.
Di Marco, S., and Osti, F. (2009). Effect of biostimulant sprays on Phaeomoniella chlamydospora and esca proper infected vines under greenhouse and field conditions. Phytopathol. Mediterr. 48, 47–58.
Eroğul, D., Karabıyık, H., & Çantal, D. (2022). Effect of foliar treatments of seaweed on fruit quality and yield in almond cultivation. Ege Üniversitesi Ziraat Fakültesi Dergisi, 59(4), 591-600.
Filatov, V. P. (1944). Tissue therapy in ophthalmology. Am. Rev. Sov. Med. 2, 53–66.
Filatov, V. P. (1951). Tissue treatment. (Doctrine on biogenic stimulators). I. Background, methods and the clinical tissue treatment. Priroda 11, 39–46.
Gazdag, O., Takács, T., Ködöböcz, L., Krett, G., & Szili-Kovács, T. (2019). Alphaproteobacteria communities depend more on soil types than land managements. Acta Agriculturae Scandinavica, Section B—Soil & Plant Science, 69(2), 147-154.
Hamza, B., and Suggars, A. (2001). Biostimulants: myths and realities. TurfGrass Trends 8, 6–10. Available online at: http://archive.lib.msu.edu/tic/tgtre/2001.
Handelsman, J., Liles, M., Mann, D., Riesenfeld, C., & Goodman, R. M. (2002). Cloning the metagenome: Culture-independent access to thediversity and functions of the uncultivated microbial world. Methods in microbiology, 33, 241-255.
Kauffman, G.L., Kneivel, D.P., Watschke, T.L., 2007. Effects of a biostimulant on the heat tolerance associated with photosynthetic capacity, membrane thermostability, and polyphenol production of perennial ryegrass. Crop Sci. 47, 261–267.
López‐Hidalgo, C., Meijón, M., Lamelas, L., & Valledor, L. (2021). The rainbow protocol: A sequential method for quantifying pigments, sugars, free amino acids, phenolics, flavonoids and MDA from a small amount of sample (Vol. 44, No. 6, pp. 1977-1986). Chichester, UK: John Wiley & Sons, Ltd.
Markets and Markets, 2025 (https://www.marketsandmarkets.com/Market-Reports/biostimulant-market-1081.html). Último acceso: 01/06/2025
Mondragon-Valero, A., Malheiro, R., Salazar, D. M., Martinez-Tome, J., Pereira, J. A., & Lopez-Cortes, I. (2020). The development of the radicular and vegetative systems of almond trees with different rootstocks following the application of biostimulants. SPANISH JOURNAL OF AGRICULTURAL RESEARCH, 18, e0904.
Moreno Gracia, B., Laya Reig, D., Rubio-Cabetas, M. J., & Sanz García, M. Á. (2021). Study of phenolic compounds and antioxidant capacity of spanish almonds. Foods, 10(10), 2334.
Mukhopadhyay, M., Mukherjee, A., Ganguli, S., Chakraborti, A., Roy, S., Choudhury, S. S., … & Mitra, A. K. (2023). Marvels of Bacilli in soil amendment for plant-growth promotion toward sustainable development having futuristic socio-economic implications. Frontiers in microbiology, 14, 1293302.
Oberson, A., & Joner, E. J. (2005). Microbial turnover of phosphorus in soil. Organic phosphorus in the environment, 133-164.
Oliveira, I., Afonso, S., Pinto, L., Vieira, S., Vilela, A., & Silva, A. P. (2022). Preliminary Evaluation of the Application of Algae-Based Biostimulants on Almond. Plants, 11(22), 3083.
Oliveira, I., Afonso, S., Pinto, L., Vieira, S., Vilela, A., & Silva, A. P. (2022). Preliminary Evaluation of the Application of Algae-Based Biostimulants on Almond. PLANTS-BASEL, 11, 3083.
Pascoalino, L. A., Reis, F. S., Barros, L., Rodrigues, M. A., Correia, C. M., Vieira, A. L., Ferreira, I. C. F. R., & Barreira, J. C. M. (2021). Effect of Plant Biostimulants on Nutritional and Chemical
Profiles of Almond and Hazelnut. APPLIED SCIENCES-BASEL, 11, 7778.
Tarantino, A., Frabboni, L., & Disciglio, G. (2024). Vegetative and Reproductive Responses Induced by Organo-Mineral Fertilizers on Young Trees of Almond cv. Tuono Grown in a Medium-High Density Plantation. AGRICULTURE-BASEL, 14, 230.
Thomas, M., Chauhan, D., Patel, J., and Panchal, T. (2013). Analysis of biostimulants made by fermentation of Sargassum tenerimum seaweed. Int. J. Curr. Trop. Res. 2, 405–407.
Traon, D., Amat, L., Zotz, F., and du Jardin, P. (2014). A Legal Framework for Plant Biostimulants and Agronomic Fertiliser Additives in the EU. Report to the European Commission, DG Enterprise & Industry, Arcadia International, 115.
Vance, E. D., Brookes, P. C., & Jenkinson, D. S. (1987). Microbial biomass measurements in forest soils: determination of kc values and tests of hypotheses to explain the failure of the chloroform fumigation-incubation method in acid soils. Soil Biology and Biochemistry, 19, 689-696.